Решая совместно уравнения (2), (5), (9), получим выражение для полной энергии электрона в атоме водорода:
| (10) |
Уравнение (10) определяет разрешенные значения энергии электрона в атоме водорода. Число n принимает целые значения n = 1,2,3, …¥ . Таким образом, энергия электрона в атоме водорода может иметь не любые значения, а только дискретный набор значений, определяемых числом n, или, как говорят, энергия электрона квантуется.
Подставляя значения
массы и
заряда электрона, постоянных 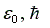 в
уравнение (10) и выражая энергию в электронвольтах
(эВ) (1эВ = 1,6.10-19
Дж), получим
формулу
в
уравнение (10) и выражая энергию в электронвольтах
(эВ) (1эВ = 1,6.10-19
Дж), получим
формулу
| (11) |
Энергия основного состояния (при n = 1), равна E1= - 13,6 эВ. На рис. 1 приведена диаграмма энергетических уровней электрона в атоме водорода, на которой горизонтальными прямыми отмечены разрешенные значения энергии. Все состояния с величиной n= 1 … ¥ являются связанными. При увеличении числа n энергетические уровни сближаются все больше и больше. При n ® ¥ E ® 0. Энергетические состояния с энергией E ³ 0 соответствуют тому, что электрон становится свободным (не связанным с ядром).
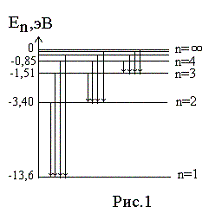 Диаграмма
энергетических уровней (рис.1) позволяет
дать несколько важных определений.
Диаграмма
энергетических уровней (рис.1) позволяет
дать несколько важных определений.
Энергия возбуждения Евоз – это энергия, которую необходимо сообщить электрону, чтобы он из основного состояния (n = 1) перешел в возбужденное. Например, Евоз = 10,2 эВ – энергия, необходимая для перехода электрона в состояние, соответствующее n = 2 (первое возбужденное состояние).
Энергия ионизации Еион – энергия, необходимая для отрыва электрона, находящегося в основном состоянии (n = 1), от ядра, т.е. для перевода электрона на уровень с n = ¥ . Для атома водорода энергия ионизации равна 13,6 эВ.
Согласно
постулату Бора, при переходе электрона из одного состояния (с большей энергией) в другое (с меньшей энергией) испускается фотон, частота которого определяется формулой (8). Учитывая выражение (10) для энергии электрона в атоме, получим выражение для частот испускаемых фотонов:| (12) |
или, соответственно, для длин волн испускаемых фотонов:
| (13) |
где Ry = 1,0974.107 м–1 – так называемая постоянная Ридберга.
Таким образом, модель атома Н.Бора объясняет дискретный (линейчатый) характер спектра испускания атома водорода.
Спектральные серии атома водорода
На диаграмме энергетических уровней (рис.1) показаны возможные переходы электрона с верхних уровней на нижние. При каждом таком переходе излучается фотон с частотой, определяемой формулой (12), или длиной волны, определяемой формулой (13). Переходы электрона с различных верхних уровней на определенный нижний образуют так называемые спектральные серии атома водорода. Так, все переходы из состояний с n = 2, 3, 4, … в состояние с n = 1 образуют так называемую серию Лаймана (ультрафиолетовое излучение). Все длины волн этой серии лежат в ультрафиолетовой области шкалы электромагнитных волн. Переходы из состояний с n = 3, 4, 5, … в состояние с n = 2 образуют серию Бальмера (видимый свет). Переходы из состояний с n = 4, 5, 6, … в состояние с n = 3 образуют серию Пашена (инфракрасное излучение). Длины волн всех остальных серий (переходы на уровни с n = 4, 5, и т.д.) лежат в инфракрасной области спектра электромагнитного излучения.